Mnohé chemické reakce,
při nichž látky reagují ve vodném prostředí, jsou často ovlivňovány kyselostí
nebo zásadivostí reakční směsi. Proto je měření kyselosti nebo zásaditosti
reakčního prostředí nutné v četných průmyslových oborech. K měření potenciometrie
se používá především metoda POTENCIOMETRICKÁ.
Stejně jako kyseliny, zásady a soli disociuje částečně také voda -
na anionty H+ a OH- pro dosiační konstantu vody K platí vztah
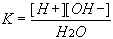
Jelikož na [H20] lze pohlížet jako na konstantu, můžeme
psát, že Kv=[H+][OH-] kde iontový součinitel vody Kv
= 10-14 při teplotě 22°C.Protože koncentrace (resp. její číselné
hodnoty) iontů H+ a iontů OH- je stejná, je : [H+] = 10-7 [OH-]
=10-7
Hodnota Ph je tedy koncentrace vodíkových iontů a je definována jako
záporný dekadický logaritmus číselné hodnoty koncentrace vodíkových iontů
(v mol l-1) v čisté vodě.
pH =-log[H+] pH=-log cH+
Koncentrace vodíkových iontů v destilované vodě je 10-7
mol l-1 a stejná je i koncentrace iontů OH-. Destilovaná voda
má pH=7. Roztoky o pH menším než 7 jsou kyselé a s pH větším než 7 jsou
zásadité.
Podle dřívějších představ byla koncentrace vodíkových iontů považována
za součin analytické koncentrace a dislokačního stupně a.
Později se však zjistilo, že kyselina chlorovodíková i jiné kyseliny nebo
zásady jsou ve vodních roztocích zcela disociovány, tj. jsou rozloženy
v ionty, přičemž dochází k intenzivnímu vzájemnému ovlivňování opačně nabitých
iontů. Za těchto poměrů se neuplatňuje skutečná koncentrace iontů, tj.
počet iontů v 1litru, nýbrž jen efektivní koncentrace, projevující se tzv.
aktivitou a. Aktivita aH+ je hodnota koncentrace iontů H+, zmenšená vlivem
vzájemného působení iontů:
aH+=facH+
kde cH+ je koncentrace iontů H+, fa - aktivní
koeficient.
Koncentrace se dnes nahrazuje aktivitou vodíkových iontů. Termodynamicky
správná definice pH je tedy:
pH=-log aH+
Analogicky jako pH byla definována pro alkalické roztoky veličina pOH
pOH = -log aOH -
mezi veličinami pH a pOH platí jednoduchý vztah pH+pOH=14
|